Pancytopénie à J8 de chimiothérapie chez un patient de 65 ans
Scénario clinique
Un patient de 65 ans hospitalisé pour la prise en charge de son cancer du poumon présente une pancytopénie à 8 jours de sa chimiothérapie.
Ses autres antécédents sont une BPCO post tabagique et une HTA.
Le bilan biologique retrouve une atteinte sévère des trois lignées avec notamment une thrombopénie à 9 G/l.
Le bilan de coagulation est normal.
Quelle est votre hypothèse étiologique concernant la thrombopénie ? Que proposez-vous ?
Les réponses
Il s’agit certainement d’une thrombopénie d’origine centrale dans le cadre d’une aplasie post chimiothérapie.
Devant une thrombopénie < 20 G/l, il faut transfuser un concentré plaquettaire pour prévenir la survenue d’un syndrome hémorragique grave (hémorragie intracrânienne, notamment).
Analyse pédagogique du cas clinique
Quel est le raisonnement étiologique ?
Il existe trois grands types de thrombopénie :
- thrombopénie centrale en lien avec un défaut de production.
- thrombopénie périphérique en lien avec un excès de destruction ou de consommation périphérique
- thrombopénie liée à un trouble de la distribution.
En réanimation, les étiologies sont souvent multiples et intriquées.
Causes de thrombopénie en réanimation (liste non exhaustive)
Thrombopénie centrale
- Médicaments : chimiothérapie, antibiotiques, antiépileptiques…
- Alcoolisme chronique
- Infection : famille des herpes virus, VIH, tuberculose, parvovirus B19
- Carence en vitamines B9 et B12
- Hémopathie et cancer : infiltration médullaire, myélodysplasie, aplasie médullaire
- Syndrome d’activation macrophagique
Thrombopénie périphérique
- Sepsis, choc septique, paludisme, virose
- Polytraumatisme, chirurgie lourde
- Coagulation intravasculaire disséminée, syndrome
- hémorragique
- Microangiopathie thrombotique, HELLP syndrome
- Thrombopénie induite à l’héparine
- Thrombopénie médicamenteuse immunoallergique
- Purpura thrombopénique immunologique
- Thrombopénie par allo-immunisation (purpura posttransfusionnel)
- Circulation extracorporelle
Thrombopénie de maldistribution
- Splénomégalie (notamment la cirrhose)
- Remplissage vasculaire, support transfusionnel
La démarche diagnostique devant une thrombopénie d’évolution aiguë n’est pas la même que celle à adopter devant une thrombopénie d’évolution ancienne.
Il est nécessaire de rechercher un diagnostic pouvant mettre en jeu le pronostic vital du patient, en premier lieu la CIVD, en réalisant un bilan de coagulation.
Même s’il est rare, la présence d’une anémie associée doit faire évoquer un syndrome de MAT et nécessite la réalisation d’un bilan d’hémolyse ( haptoglobine, LDH, schizocytes, bilirubine libre).
La CIVD et les MAT sont deux entités graves et nécessitent un diagnostic précoce et un traitement urgent.
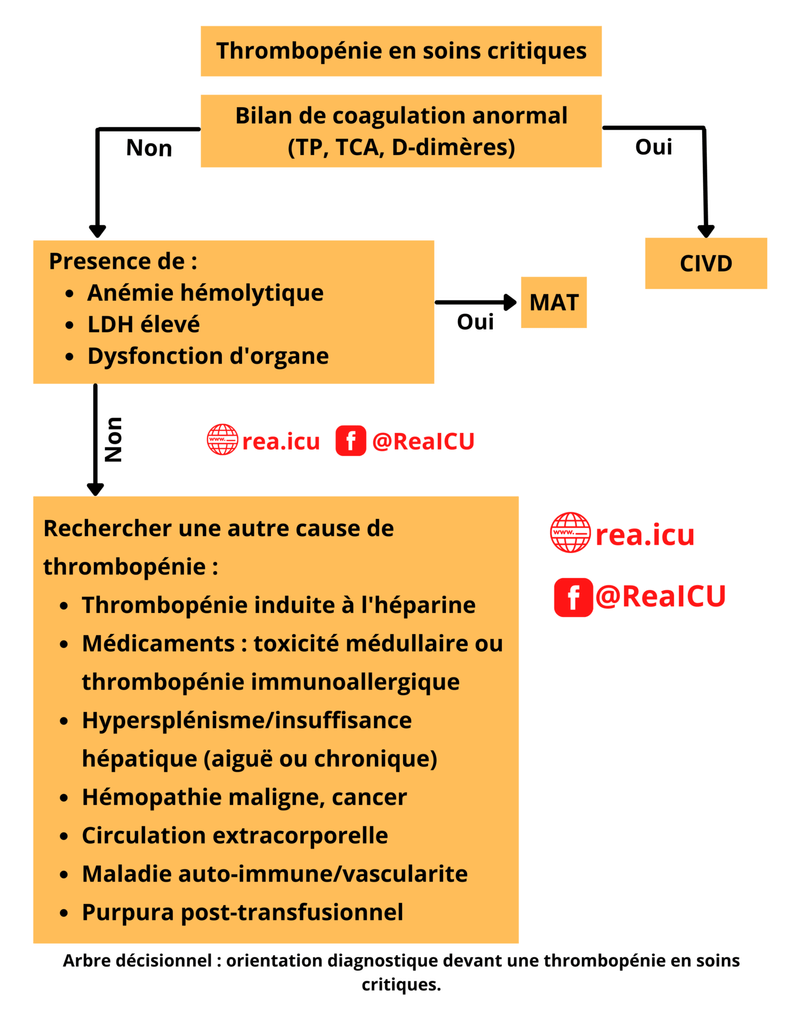
Il faut également comprendre que la CIVD a de nombreuses étiologies et que toute thrombopénie au cours d’un sepsis n’est pas synonyme de CIVD.
La thrombopénie isolée est fréquente au cours du sepsis.
La survenue d’une thrombopénie en cours d’hospitalisation chez un patient traité par héparine doit systématiquement faire évoquer une thrombopénie induite par l’héparine.
En dehors d’élément de contexte ou de signes cliniques orientant fortement vers un diagnostic, un myélogramme doit être réalisé rapidement.
Quelle est la prise en charge initiale ?
L’indication de transfusion plaquettaire dépend de la numération plaquettaire, du contexte clinique et de la nécessité de réaliser des examens invasifs.
Le seuil de 20 G/l est habituellement retenu pour un support transfusionnel plaquettaire prophylactique car il existe une augmentation du risque d’hémorragie spontanée en dessous de ce seuil.
| Seuil (giga/l) | Indications de transfusion prophylactique de plaquettes |
| 20 | Systématique (sauf MAT) |
| 50 | Avant chirurgie mineure, ponction lombaire, ponction pleurale |
| 80 | Avant chirurgie majeure |
| 100 | Avant intervention neurochirurgicale ou chirurgie oculaire complexe |
Une transfusion plaquettaire doit être discutée pour des seuils plus élevés en cas de saignements.
L’indication de support transfusionnel doit également prendre en compte la balance bénéfice/risque.
Le support transfusionnel en plaquettes expose à plusieurs risques :
immunologique (allo-immunisation), allergique et, dans une moindre mesure, hémodynamique
(surcharge vasculaire) et infectieux (exposition virale, infection bactérienne par un produit
contaminé).
La transfusion plaquettaire favorise l’allo-immunisation et peut compromettre le rendement transfusionnel ultérieur.
Il faut également noter que la transfusion plaquettaire peut aggraver certaines pathologies (par exemple, la CIVD et la MAT).
La posologie dépend du poids et du taux de plaquettes du patient. Elle est calculée par l’établissement délivrant le produit labile sanguin.
À propos de quelques causes rencontrées en médecine intensive réanimation
A- Thrombopénie induite par l’héparine (TIH)
La TIH est liée à l’activation plaquettaire par un anticorps anti-facteur 4 plaquettaire (anti-PF4) qui est stimulé par l’héparine. Elle survient plus fréquemment sous héparine non fractionnée que sous héparine de bas poids moléculaire.
Le score « 4 T », incluant le nadir de la thrombopénie, sa cinétique d’installation, la présence ou l’extension de thrombose et l’existence d’un éventuel diagnostic différentiel, permet de définir une probabilité diagnostique. La mise en évidence de l’anticorps anti-PF4 permet de confirmer le diagnostic. Même s’il s’agit d’une thrombopénie, le risque lié à cette entité n’est pas hémorragique mais thrombotique.
Il existe deux types de TIH :
- type 1, non immunologique : la thrombopénie survient dans les 5 premiers jours et est asymptomatique ;
- type 2, immunologique : la thrombopénie survient entre le 5e et 21e jour et s’accompagne de thromboses vasculaires dans 50 % des cas
Les délais de survenue peuvent être plus courts en cas d’exposition préalable à l’héparine.
En cas de suspicion diagnostique, il est nécessaire d’arrêter l’héparine et de la remplacer par un anticoagulant apparenté : danaparoïde (Orgaran®) ou lépirudine (Refludan®).
En cas d’insuffisance rénale, l’argatroban (Arganova®) est indiqué. S’il existe une thrombose, la posologie doit être curative.
B- Coagulation intravasculaire disséminée (CIVD)
Toutes les situations aiguës critiques (sepsis, polytraumatisme, choc hémorragique…) sont associées à une activation de l’inflammation, allant dans certains cas jusqu’à une CIVD.
B 1 – Définition : La CIVD correspond à la défaillance du système de coagulation caractérisée par l’activation de la coagulation et de la fibrinolyse. Il existe une consommation des facteurs de coagulation et une déplétion des inhibiteurs de la coagulation.
B 2 – Physiopathologie : L’étape initiale de la CIVD implique la voie du facteur tissulaire (FT).
L’expression ou la libération excessive du facteur tissulaire par de nombreux types de cellules (monocytaires, endothéliales, tumorales, placentaires, prostatiques, pulmonaires) génère une activation diffuse de la coagulation avec consommation des facteurs de coagulation. Il s’ensuit une réaction fibrinolytique.
Il existe une activation systémique de la coagulation qui intéresse conjointement la thrombinoformation et la plasminoformation.
La résultante est la formation de microthrombus dans les vaisseaux de manière diffuse.
La thrombopénie est expliquée par la captation des plaquettes circulantes par les microthrombus.
B 3 – Causes La première cause de CIVD est le sepsis (en particulier les bactériémies à bacilles à Gram négatif). La CIVD complique 30 % des sepsis.
En réanimation, les deux autres principales causes sont le polytraumatisme et l’hémorragie obstétricale.
La leucémie aiguë promyélocytaire (LAM 3) est souvent associée à une CIVD. La LAM3 est rare mais ne doit pas être ignorée car elle nécessite un traitement spécifique urgent.
B 4 – Diagnostic positif : Les critères diagnostiques de CIVD associent :
- thrombopénie.
- diminution du TP.
- augmentation des marqueurs de la dégradation de la fibrine.
- diminution du taux de fibrinogène (peut être normal au cours du sepsis).
B 5 – Prise en charge (à titre indicatif) Le premier traitement est étiologique. Le traitement symptomatique consiste à limiter le risque hémorragique par l’apport des facteurs de coagulation (PFC), du fibrinogène et de plaquettes.
L’apport de complexe prothrombinique (CCP) est contre-indiqué car il existe un risque d’aggravation de la CIVD. Le plasma frais congelé (PFC) contient un ensemble de facteurs de coagulation et permet un équilibre entre coagulation et fibrinolyse, tandis que le complexe prothrombinique ne contient que des facteurs favorisant la coagulation et expose ainsi à un risque de thrombose.
C- Syndrome de microangiopathie thrombotique (MAT)
Le syndrome de microangiopathie thrombotique est un ensemble de maladies caractérisées par la constitution de thromboses microcirculatoires.
Le syndrome de microangiopathie thrombotique est défini de manière clinique et biologique par :
- une anémie hémolytique (élévation du taux des LDH et de la bilirubine libre,
- effondrement de l’haptoglobine) mécanique (présence de schizocytes et test de Coombs négatif) ;
- une thrombopénie périphérique de consommation ;
- une défaillance d’organe de sévérité variable par ischémie microcirculatoire (essentiellement insuffisance rénale aiguë et signes neurologiques centraux).
L’atteinte correspond histologiquement à une occlusion artériolaire par des thrombus fibrineux.
Le frottis sanguin met en évidence des schizocytes avec un aspect dit en « bicorne » ou en « cimier de casque ».
Il existe plusieurs formes de MAT :
• le purpura thrombotique thrombocytopénique (PTT) ;
• le syndrome hémolytique et urémique typique (SHU typique) ;
• le syndrome hémolytique et urémique atypique (SHU atypique) ;
• les microangiopathies thrombotiques secondaires (HTA maligne, cancer métastatique, VIH, médicaments, HELPP syndrome…).
C 1 – Purpura thrombotique thrombocytopénique (PTT)
Cette maladie est caractérisée par un déficit d’activité en ADAMTS13 le plus souvent acquis, auto-immun, beaucoup plus rarement congénital. L’ADAMTS13 est une métalloprotéase permettant le clivage du facteur Willebrand impliqué dans l’hémostase primaire. En l’absence de clivage par l’ADAMTS13, les multimères de facteur Willebrand deviennent hyper-adhésifs et s’agrègent avec les plaquettes. En s’accumulant, ils sont à l’origine de la formation de microthrombus au sein des capillaires et des artérioles de la microcirculation, responsables d’une ischémie et d’une souffrance viscérale disséminée.
La présentation clinique associe une fièvre, une anémie hémolytique et une thrombopénie.
L’atteinte d’organe est :
- le plus souvent une atteinte cérébrale (signes neurologiques fluctuants comme des paresthésies, des céphalées, des signes neurosensoriels, jusqu’à un AVC, une crise épileptique ou un coma) ;
- parfois une atteinte cardiaque (élévation des troponines, tachycardie sinusale, infarctus du myocarde) ;
- rarement une atteinte rénale (qui oriente plutôt vers un SHU).
Une activité ADAMTS13 inférieure à 5–10 % signe le diagnostic. Le diagnostic étiologique s’effectue par la recherche d’anticorps anti-ADAMTS13.
Le traitement par échanges plasmatiques est instauré en urgence avant réception du résultat de l’activité ADAMTS13. La transfusion plaquettaire n’est pas indiquée et pourrait aggraver la symptomatologie.
C 2 Syndrome hémolytique et urémique typique (SHU typique)
Le SHU typique se manifeste classiquement par des diarrhées fébriles chez un enfant. La diarrhée est sanglante dans 70 % des cas. L’atteinte d’organe est une insuffisance rénale aiguë d’apparition brutale avec hématurie, protéinurie, hypertension artérielle, parfois anurie. L’atteinte d’autres organes (en particulier système nerveux central) est possible mais reste toutefois rare et n’évoque pas en première intention un SHU typique.
L’Escherichia coli entérohémorragique producteur de shigatoxine (STEC) est le germe causal le plus fréquent. Le diagnostic est réalisé par la culture des selles et recherche de shigatoxine par PCR dans les selles.
Le traitement est uniquement symptomatique. Une épuration extrarénale est parfois nécessaire.
Le SHU post-diarrhéique avant l’âge de 15 ans est une maladie à déclaration obligatoire.
C 3 Syndrome hémolytique et urémique atypique (SHU atypique)
Il s’agit d’une entité rare en lien avec une anomalie de la voie alterne du complément dont la protéine C5 est centrale. La défaillance d’organe est le plus souvent une défaillance rénale.
C 4 Microangiopathies thrombotiques (MAT) secondaires
Les MAT secondaires sont plus fréquentes que les formes primitives. Les causes sont nombreuses : HTA maligne, cancer métastatique, VIH, médicaments, HELLP syndrome…
C 5 Démarche diagnostique devant un syndrome de microangiopathies thrombotique (MAT)
Devant une thrombopénie avec anémie, il est nécessaire de rechercher une hémolyse mécanique par la réalisation d’un bilan d’hémolyse et la recherche de schizocytes.
Une fois le syndrome de MAT identifié, il faut doser l’activité ADAMTS13 et s’aider du contexte
- la présence de diarrhée glairosanglante fébrile avec une insuffisance rénale aiguë chez un enfant oriente vers un SHU typique ;
- la présence d’une atteinte cérébrale oriente vers un PTT ;
- il faut également évoquer d’autres causes spécifiques de syndrome de MAT (HELLP syndrome chez la femme enceinte, HTA maligne, cancer, certaines chimiothérapies,
complications liées au VIH et à la transplantation d’organe).
En l’absence de tableau évident de SHU typique et/ou de signes orientant de façon évidente vers une MAT secondaire, il est nécessaire de débuter en urgence des échanges plasmatiques.